ΡΥΘΜΙΣΤΙΚΑ ΔΙΑΛΥΜΑΤΑ
ΠΑΡΑΣΚΕΥΗ ΚΑΙ ΕΛΕΓΧΟΣ ΡΥΘΜΙΣΤΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ
ΔΙΔΑΚΤΙΚΟΙ ΣΤΟΧΟΙ
Στο τέλος αυτής της ώρας
ο μαθητής πρέπει να είναι σε θέση:
—Nα αναγνωρίζει ένα
ρυθμιστικό δάλυμα
—Να γνωρίζει τις
ιδιότητες ενός ρυθμιστικού διαλύματος καθώς και τη σημασία τους.
—Να μπορεί να εξάγει
υπολογιστικά τον τύπο Henderson-Hasselbalch και να μπορεί να τον
εφαρμόζει όταν δίνεται συζυγιακό ζεύγος οξέος-βάσης.
—Επίσης, κρίνεται σκόπιμο να εφαρμόζει την παραπάνω
εξίσωση σε περίπτωση προσθήκης μικρών ποσοτήτων ισχυρού οξέος ή βάσης ή όταν το
διάλυμα αραιώνεται εντός κάποιων ορίων.
ΔΙΑΓΡΑΜΜΑ ΡΟΗΣ-ΦΑΣΕΙΣ
ΦΑΣΗ 1
Αρχικά
ρωτάμε τους μαθητές αν μπορούν να συνυπάρχουν σε ένα διάλυμα σε ισορροπία ένα
οξύ και μία βάση. Η απάντηση που περιμένουμε από τους μαθητές είναι αυτή της
περίπτωσης όπου έχουμε επίδραση κοινού ιόντος. Στα
διαλύματα αυτά το PH
του διαλύματος εξαρτάται
από το λόγο των συγκεντρώσεων HA/A- δεδομένου ότι η
σταθερά ιοντισμού είναι ka=(H+
)( A-)/(HA).
Tα διαλύματα αυτά περιέχουν το συζυγές ζεύγος HA/A- ή Β/ΒΗ+ και
μπορούν και διατηρούν το PH
τους σταθερό ακόμα και
όταν προστεθεί σε αυτά μια μικρή αλλά υπολογίσιμη ποσότητα ισχυρού οξέος ή
βάσης ή όταν το διάλυμα αραιωθεί εντός κάποιων ορίων. Οι
συγκεντρώσεις των συστατικών του ρυθμιστικού πρέπει να είναι σχετικά υψηλές
(συνήθως είναι 0.1-1Μ )
ώστε να έχει ικανοποιητική ρυθμιστική ικανότητα (αντοχή
δηλαδή στις μεταβολές του PH κατά
την προσθήκη ισχυρού οξέος ή βάσης ή νερού).
Αναφέρουμε
ένα ρυθμιστικό διάλυμα π.χ CH3COOH/CH3OCOONa. To διάλυμα αυτό θα μπορεί
να δεσμεύει μικρές ποσότητες ισχυρού οξέος ή βάσης τα οποία θα αντιδρούν με τα CH3COOH και CH3COO- σύμφωνα με τις εξισώσεις:
CH3COOH+OH-→CH3COO-+H2O ή
CH3COO-+H3O+→CH3COOH+H2O
μετατρέποντας
το ένα συστατικό στο άλλο. Τα ιόντα οξωνίου προέρχονται από τον ιοντισμό της
ισχυρής βάσης ενώ τα ιόντα υδροξυλίου από τη διάσταση της ισχυρής βάσης, όταν η
βάση και το οξύ προστίθενται αντίστοιχα
στο διάλυμα. Κατά τις παραπάνω προσθήκες
οι συγκεντρώσεις των συστατικών του ρυθμιστικού μεταβάλλονται ελάχιστα
με αποτέλεσμα ο λόγος των συγκεντρώσεων να μεταβάλλεται ελάχιστα (ακόμη πιο
λίγο μεταβάλλεται ο λογάριθμος του λόγου των
συγκεντρώσεων στην εξίσωση Henderson-Hasselbalch, οπότε
το PH παραμένει πρακτικά
σταθερό). Τη μεγάλη ρυθμιστική αντοχή του ρυθμιστικού αντιλαμβανόμαστε και με
το παράδειγμα που ακολουθεί.
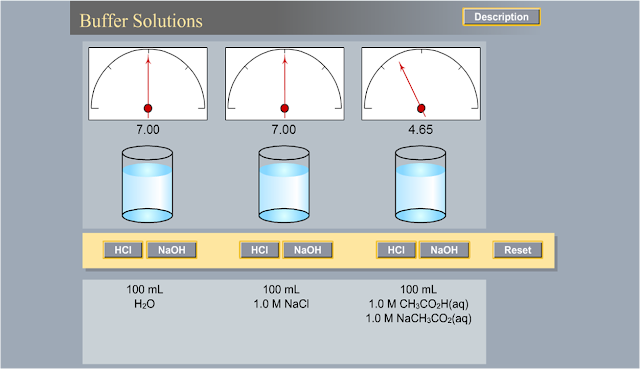
—Στο λογισμικό του
εικονικού εργαστηρίου που παραθέτουμε έχουμε τρία ποτήρια ζέσεως των 100ml μέσα στα οποία υπάρχουν
αντίστοιχα καθαρό νερό, υδατικό διάλυμα Nacl και
το ρυθμιστικό διάλυμα του CH3COOH/CH3OCOONa. Κάτω από κάθε διάλυμα
δίνεται η δυνατότητα προσθήκης HCl και NaOH , οπότε και παρατηρείται η
μεταβολή στο PH
του διαλύματος.
 Ενώ
με την προσθήκη του οξέος και της βάσης στο καθαρό νερό και στο διάλυμα του
άλατος το PH αλλάζει δραματικά, δεν
παρατηρούμε κάτι αντίστοιχο και στο διάλυμα του ρυθμιστικού. Χαρακτηριστικά με
την προσθήκη του HCl στο ρυθμιστικό το PH από 4,74 μεταβάλλεται
στο 4,65.
Ενώ
με την προσθήκη του οξέος και της βάσης στο καθαρό νερό και στο διάλυμα του
άλατος το PH αλλάζει δραματικά, δεν
παρατηρούμε κάτι αντίστοιχο και στο διάλυμα του ρυθμιστικού. Χαρακτηριστικά με
την προσθήκη του HCl στο ρυθμιστικό το PH από 4,74 μεταβάλλεται
στο 4,65.
Αξίζει να αναφέρουμε ότι
η ποσότητα του ισχυρού οξέος ή της ισχυρής βάσης που προσθέτουμε πρέπει να
είναι μικρή σε σχέση με τα ποσότητες των συστατικών του ρυθμιστικού διαφορετικά
η μεταβολή του PH θα είναι σημαντική αφού
υπάρχει περίπτωση να καταναλωθεί σημαντική ή και ολόκληρη η ποσότητα του
ρυθμιστικού οπότε χάνεται η ρυθμιστική ικανότητα του διαλύματος.
Στο διάγραμμα που ακολουθεί γίνεται
διαγραμματική αναπαράσταση της ρυθμιστικής ικανότητας ενός ρυθμιστικού
διαλύματος της μορφής HA/A- με ίσες συγκεντρώσεις
κατά την προσθήκη ισχυρού οξέος ή βάσης.
ΦΑΣΗ 2
Στη φάση αυτή θα εξάγουμε τη μαθηματική σχέση από την
οποία προκύπτει το PH ενός ρυθμιστικού
διαλύματος. Έστω ρυθμιστικό διάλυμα που αποτελείται από το συζυγές ζεύγος HA/A- με συγκεντρώσεις Cοξέοςκαι Cβάσης αντίστοιχα. Σε κάθε ρυθμιστικό
διάλυμα που περιέχει ένα συζυγιακό σύστημα οξέος-βάσης, όπως έχουμε δει, ισχύει
η σχέση:
Όπως προκύπτει από την
παραπάνω σχέση το PH
ενός ρυθμιστικού
διαλύματος εξαρτάται από την τμή Ka του οξέος καθώς και από το λόγο των συγκεντρώσεων των
συστατικών του λ=Cβάσης/Cοξέος. Ως εκ τούτου όταν οι συγκεντρώσεις αυτές είναι ίσες ισχύει:
PH=Pka
Για να παρασκευάσουμε,
λοιπόν, ένα ρυθμιστικό διάλυμα με μια ορισμένη τιμή PΗ αρκεί να επιλέξουμε
ένα ασθενές οξύ με τιμή pka όσο το δυνατόν πλησιέστερα στην τιμή του PH που θέλουμε.Στο
παράδειγμα που ακολουθεί χρησιμοποιώντας λογισμικό εικονικού εργαστηρίου
παρατηρούμε ότι για ίσες συγκεντρώσεις ρυθμιστικού το PH=Pka .

ΦΑΣΗ 3
Συνδέουμε
τη θεωρητική προσέγγιση του θέματος με την παρακάτω πειραματική διαδικασία στην
οποία θα επιλεγεί κατάλληλο σύστημα ηλεκτρολυτών για την παρασκευή Ρ.Δ
συγκεκριμένου PH,
υπολογισμός της τιμής
του PH με την εξίσωση Henderson-Hasselbalch και
προσδιορισμός της μεταβολής του PH κατά την προσθήκη ισχυρού οξέος ή βάσης (έλεγχος
ρυθμιστικής ικανότητας).
ΠΡΟΤΕΙΝΟΜΕΝΕΣ ΑΣΚΗΣΕΙΣ
Ασκήσεις για επίλυση στο
σχολείο: Παραδείγματα 3.14, 3.15, 3.16.
Ασκήσεις για επίλυση στο
σπίτι: 76, 77, 78, 79, 79, 80, 81, 82, 85,86
Χρόνος διδασκαλίας:45 λεπτά
ΔΙΑΓΡΑΜΜΑ ΡΟΗΣ- ΔΙΔΑΚΤΙΚΕΣ ΕΝΕΡΓΕΙΕΣ
ΠΕΙΡΑΜΑ
ΠΑΡΑΣΚΕΥΗ ΡΥΘΜΙΣΤΙΚΟΥ ΔΙΑΛΥΜΑΤΟΣ ΚΑΙ ΕΛΕΓΧΟΣ ΡΥΘΜΙΣΤΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ
ΠΑΡΑΣΚΕΥΗ ΡΥΘΜΙΣΤΙΚΟΥ ΔΙΑΛΥΜΑΤΟΣ ΚΑΙ ΕΛΕΓΧΟΣ ΡΥΘΜΙΣΤΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ
ΔΙΔΑΚΤΙΚΟΙ
ΣΤΟΧΟΙ
—Στο τέλος του πειράματος ο μαθητής θα είναι σε θέση να
παρασκευάζει ρυθμιστικά διαλύματα είτε με απ΄ευθείας ανάμιξη ασθενούς οξέος με
τη συζυγή της βάση είτε με μερική εξουδετέρωση ασθενούς οξέος από ισχυρή βάση
είτε με μερική εξουδετέρωση ασθενούς βάσης από ισχυρό οξύ.
—Να μπορεί ο μαθητής να επαληθεύει εργαστηριακά τη ρυθμιστική αντοχή του
διαλύματος που παρασκεύασε με προσθήκη μικρής ποσότητας ισχυρού οξέος, ισχυρής
βάσης καθώς και με αραίωση.
—Να μπορεί να επιλέγει κάθε φορά τα κατάλληλα συστατικά
ρυθμιστικού ανάλογα με την τιμή του PH του διαλύματος που
επιθυμεί να παρασκευάσει.
ΘΕΩΡΗΤΙΚΗ ΠΡΟΣΕΓΓΙΣΗ ΤΟΥ
ΘΕΜΑΤΟΣ -ΑΡΧΗ ΜΕΘΟΔΟΥ
Έστω
υδατικό διάλυμα που περιέχει το ασθενές οξύ HA με συγκέντρωση Cκαι
το άλας ΝαΑ με συγκέντρωση C΄.Το
διάλυμα αυτό είναι ρυθμιστικό επειδή περιέχει το ασθενές οξύ ΗΑ και τη συζυγή
του βάση Α-
(προκύπτει από τη διάσταση του άλατος ΝaA). Το άλας NaA είναι ισχυρός ηλεκτρολύτης και διίσταται
πλήρως:

Η
παραπάνω σχέση ισχύει με την προϋπόθεση ότι επιτρέπονται οι γνωστές
προσεγγίσεις, δηλαδή
—Η συγκέντρωση του οξέος στην ισορροπία είναι περίπου ίση με την αρχική του.
—Η συγκέντρωση της συζυγούς βάσης στην ισορροπία είναι περίπου ίση με την αρχική συγκέντρωση
της βάσης.
Παρατηρήσεις:
1)Σε
όλα τα ρυθμιστικά διαλύματα υπάρχει επίδραση κοινού ιόντος. Επειδή οι
συγκεντρώσεις των συστατικών του είναι σχετικά μεγάλες επιτρέπονται οι γνωστές
προσεγγίσεις.
2)Σ ε
κάθε ρυθμιστικό διάλυμα ισχύει ησχέση:
Η
σχέση αυτή δεν είναι ανεξάρτητη από τη σχέση
αφού
οι σταθερές ιοντισμού Κa και Κb συνδέονται μεταξύ τους με τη σχέση:
KaKb=Kw.
Ένα δεύτερο θέμα στα Ρ.Δ. είναι η εκτίμηση της ρυθμιστικής
τους ικανότητας. Έτσι, αν σε ορισμένο όγκο του Ρ.Δ. προστεθεί μικρή ποσότητα
ισχυρού οξέος ή βάσης, θα μεταβληθούν ελάχιστα τα c και c’ ,
λιγότερο ο λόγος τους c/ c’ και ακόμη λιγότερο ο λογάριθμος του λόγου αυτού. Γι’ αυτό, λοιπόν, αναμένεται μικρή σχετικά
μείωση της τιμής του pH. Μπορεί να οριστεί ως ρυθμιστική
ικανότητα ενός Ρ.Δ. τα mole ισχυρού οξέος ή βάσης, τα οποία πρέπει να προστεθούν σε 1 L αυτού, ώστε να μεταβληθεί η τιμή του pH κατά
μία μονάδα.
Η ρυθμιστική ικανότητα εξαρτάται από τις
συγκεντρώσεις (cοξέος, cβάσης) των συστατικών και το pH του Ρ.Δ.
Η ρυθμιστική ικανότητα είναι μέγιστη όταν οι συγκεντρώσεις
των δύο συστατικών είναι ίσες (cοξέος = cβάσης). Από την εξίσωση του Henderson προκύπτει ότι pH=pKa ή pOH=pKb . Στη
περίπτωση αυτή το Ρ.Δ. παρουσιάζει κατά απόλυτη τιμή την ίδια ματαβολή pH κατά τη προσθήκη της
ίδιας ποσότητας ισχυρού οξέος ή ισχυρής βάσης.
Ένα Ρ.Δ. για να έχει σημαντική ρυθμιστική
ικανότητα, πρέπει ο λόγος των συγκεντρώσεων (cοξέος / cβάσης) να κυμαίνεται από 1 : 10 μέχρι
10 : 1. Για την περιοχή αυτή των συγκεντρώσεων αντιστοιχεί η εξής
περιοχή τιμών pH
:
pH= pKa + log1/10 = pKa - 1 και pH= pKa + log10/1 = pKa
+1
Στο παράδειγμα που
ακολουθεί οι συγκεντρώσεις των συστατικών ΝΗ3/ΝΗ4Cl είναι ίσες οπότε το PH του ρυθμιστικού
διαλύματος είναι ίσο με την Pka( NH4+ ) του οξέος. To παράδειγμα είναι από
λογισμικό εικονικού εργαστηρίου.
Δηλαδή
ένα ρυθμιστικό διάλυμα χρησιμοποιείται για περιοχή τιμών PH περίπου δύο μονάδες (pKa
- 1 έως pKa
+ 1 ).
Για δεδομένο λόγο συγκεντρώσεων λ=cβάσης /cοξέος
η ρυθμιστική ικανότητα είναι τόσο μεγαλύτερη, όσο
μεγαλύτερες είναι οι συγκεντρώσεις των συστατικών του ρυθμιστικού διαλύματος
(πυκνότερο διάλυμα).
Στο παράδειγμα που ακολουθεί οι συγκεντρώσεις των συστατικών ΝΗ3/ΝΗ4Cl είναι ίσες οπότε το PH του ρυθμιστικού διαλύματος είναι ίσο με την Pka( NH4+ ) του οξέος. To παράδειγμα είναι από λογισμικό εικονικού εργαστηρίου.
–Στο
ίδιο συμπέρασμα καταλήγουμε και όταν πραγματοποιηθεί αραίωση του Ρ.Δ. εντός
κάποιων ορίων όπως προκύπτει από τη παράγραφο που ακολουθεί.
Στο
πείραμα που ακολουθεί θα παρασκευαστεί ρυθμιστικό διάλυμα CH3COOH
και CH3COONa με τιμή PH=4.74 και θα γίνει έλεγχος της
ρυθμιστικής του ικανότητας με προσθήκη μικρής ποσότητας HCl και NaOH καθώς και με προσθήκη Η2Ο.
ΟΡΓΑΝΑ ΚΑΙ ΑΝΤΙΔΡΑΣΤΗΡΙΑ
Απαιτούνται:
—Oγκομετρικοί
κύλινδροι των 100ml
—Oγκομετρικές
φιάλες των 100ml
—Σιφώνι των 10 ml βαθμονομημένο
—Πεχάμετρο ρυθμισμένο όπως ορίζει ο κατασκευαστής του
—Διάλυμα CH3COOH 2M, διάλυμα NaOH 2M, διάλυμα HCl 2M
—Απιονισμένο νερό
ΠΕΙΡΑΜΑΤΙΚΗ
ΔΙΑΔΙΚΑΣΙΑ
A)ΠΑΡΑΣΚΕΥΗ ΡΥΘΜΙΣΤΙΚΟΥ ΔΙΑΛΥΜΑΤΟΣ ΜΕ PH=4.74
A)ΠΑΡΑΣΚΕΥΗ ΡΥΘΜΙΣΤΙΚΟΥ ΔΙΑΛΥΜΑΤΟΣ ΜΕ PH=4.74
Σε
ογκομετρική φιάλη των 100ml
εισάγονται με
ογκομετρικό κύλινδρο 50ml
CH3COOH
2M και 25ml διαλύματος NaOH 2M. Το διάλυμα που προκύπτει αραιώνεται με νερό μέχρι τα 100ml.Στο σημείο αυτό ζητάμε
από τους μαθητές
1.να γράψουν την αντίδραση που λαμβάνει χώρα μεταξύ των
ηλεκτρολυτών.
2.Να αναγνωρίσουν το διάλυμα ως ρυθμιστικό.
3.Να υπολογίσουν τις συγκεντρώσεις των συστστικών του
ρυθμιστικού στον τελικό όγκο των 100ml.
4.Nα
υπολογίσουν θεωρητικά από την εξίσωση Henderson-Hasselbalch την τιμή του PH που παρασκεύασαν.
5. Να συγκρίνουν τη θεωρητική τιμή με την πειραματική τιμή
του PH που θα βρουν με πεχάμετρο.
ΜΕΤΑΒΟΛΗ PH ΚΑΤΑ ΤΗΝ ΠΡΟΣΘΗΚΗ Η3Ο+ ή ΟΗ-ΣΕ 1L ΚΑΘΑΡΟΥ ΝΕΡΟΥ ΚΑΙ ΣΕ 1L ΡΥΘΜΙΣΤΙΚΟΥ CH3COOH-CH3OCOONa
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ
ΜΑΘΗΤΗ
ΟΝΟΜ/ΝΥΜΟ:
Α)ΠΑΡΑΣΚΕΥΗ ΡΥΘΜΙΣΤΙΚΟΥ ΔΙΑΛΥΜΑΤΟΣ
ΟΝΟΜ/ΝΥΜΟ:
Α)ΠΑΡΑΣΚΕΥΗ ΡΥΘΜΙΣΤΙΚΟΥ ΔΙΑΛΥΜΑΤΟΣ
Σε
ογκομετρική φιάλη των 100ml
εισάγονται με
ογκομετρικό κύλινδρο 50ml
CH3COOH
2M και 25ml διαλύματος NaOH 2M. Το διάλυμα που προκύπτει αραιώνεται με νερό μέχρι τα 100ml.
1) Nα
γράψετε την αντίδραση μεταξύ των ηλεκτρολυτών
CH3COOH+ NaOH→…………..+………….
2)Να βρείτε τα mol των ηλεκτρολυτών που
αντέδρασαν.
………………………………………………………………………………………………………..
3)Να βρείτε τις
συγκεντρώσεις των συστατικών του τελικού μίγματος στον όγκο των 100ml.
CH3COOH+ NaOH→…………..+………….
4) Να
εξετάσετε αν το διάλυμα που προκύπτει είναι ρυθμιστικό.
…………………………………………………………………………………………………………….
5)Να υπολογίσετε
θεωρητικά με την εξίσωση Henderson-Hasselbalch την τιμή του PH του διαλύματος που
παρασκευάσατε.
PHθεωρ=……………
6)Nα μετρήσετε με το
πεχάμετρο την τιμή του PH
PHπειρ=…………….
7)Να συγκρίνετε τις δύο
παραπάνω τιμές.
……………………………………………………………………………………………………………….
Β)ΕΛΕΓΧΟΣ ΡΥΘΜΙΣΤΙΚΗΣ
ΙΚΑΝΟΤΗΤΑΣ ΜΕ ΠΡΟΣΘΗΚΗ ΙΣΧΥΡΟΥ ΟΞΕΟΣ –ΒΑΣΗΣ-ΝΕΡΟΥ
—Παίρνουμε 25ml από το ρυθμιστικό που
παρασκευάσαμε και προσθέτουμε 1ml ΗCl 2M.
1)Ποια αντίδραση λαμβάνει
χώρα με την προσθήκη του HCl: Nα γράψετε τη χημική
εξίσωση:
………………………………………………………………………………………………………………………………………………………………………………………………………….
2)Nα υπολογίσετε τη σύσταση
του τελικού μίγματος σε mol
με την προσθήκη του
οξέος.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
3)Να βρείτε τις
συγκεντρώσεις των συστατικών του τελικού μίγματος και βάσει της εξίσωσης την
τιμή του PH.
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….. .
4)Να συγκρίνετε την τιμή
του PH με την προσθήκη και
χωρίς την προσθήκη του οξέος.
………………………………………………………………………………………………………….
5)Να υπολογίσετε τη
ρυθμιστική ικανότητα του διαλύματος.
………………………………………………………………………………………………………
……………………………………………………………………………………………………….
—Παίρνουμε 25ml από το ρυθμιστικό μας
και προσθέτουμε 1ml
NaOH 2M.
1)Να μετρήσετε την τιμή
του PH με πεχάμετρο και να τη
συγκρίνετε με αυτή χωρίς την προσθήκη της βάσης.
…………………………………………………………………………………………………………………
—Προσθέστε τις παραπάνω
ποσότητες οξέος και βάσης σε 25ml νερού, αφού έχετε πρώτα μετρήσει το PH του νερού με πεχάμετρο.
PHHCl…=…………………………………………………………….
—PHNaOH=………………………………………………………..
2)Eίναι σημαντική η
μεταβολή του PH:
AΣΚΗΣΕΙΣ ΓΙΑ ΤΟ ΣΠΙΤΙ
Άσκηση1
Να υπολογισθεί το pH ρυθμιστικού διαλύματος
αποτελούμενου από μυρμηγκικό οξύ (HCOOH) συγκέντρωσης 0,1Μ και
μυρμηγκικό νάτριο (HCOONa) 0,1Μ. Δίνεται η
σταθερά ιοντισμού του HCOOH Ka=10-4.
Άσκηση 2
Να υπολογισθεί το pH ρυθμιστικού διαλύματος όγκου 200 mL, που περιέχει αμμωνία (ΝΗ3) σε περιεκτικότητα 0,34%(w/v) και 5,8 g Ιωδιούχου αμμωνίου (ΝΗ4Ι). Δίνονται: Η σταθερά
ιοντισμού της ΝΗ3 Kb=10-5 , το
γινόμενο ιόντων νερού Kw=10-14, και
οι σχετικές ατομικές μάζες Ν=14, Η=1 και Ι=127.
Άσκηση3
Σε ένα λίτρο καθενός από τα παρακάτω
διαλύματα προστίθεται 0,01 mol ισχυρού οξέος ΗΑ. Σε ποιο από τα παρακάτω διαλύματα θα
προκληθεί μικρότερη μείωση του pH; α)
Διάλυμα ΝΗ3
1Μ, β) διάλυμα CH3COOH 1M, γ) Διάλυμα CH3COOH 1M – CH3COONa 1M δ) Διάλυμα CH3COOH
0,1M – CH3COONa 0,1M
Άσκηση
4
Σε
ένα λίτρο νερού διαλύουμε κάθε φορά τις παρακάτω ποσότητες:
Α) 0,l mol NH3 +
0,2 mol HCl
Β) 0,2 mol ΝΗ3 +
3,65 g HCl
Γ) 0,2 mol CH3COOH + 0,1
mol NaOH
Δ)
0,1 mol HCN + 0,1
mol KOH
Σε
ποιες περιπτώσεις θα σχηματισθεί ρυθμιστικό διάλυμα;
Άσκηση
5
Ρυθμιστικό διάλυμα έχει προέλθει από
ανάμειξη 100 mL διαλύματος ΝΗ3 1Μ
και 300mL διαλύματος HCl 0,2M.
Α) Να υπολογισθεί το pH του διαλύματος.
Β) Αν το διάλυμα αραιωθεί με νερό μέχρι
τελικού όγκου 1 λίτρου να υπολογισθεί το pH του
αραιωμένου διαλύματος. Δίνεται η σταθερά ιοντισμού της αμμωνίας Kb=10-5 και
το γινόμενο ιόντων του νερού Kw=10-14 .
Άσκηση
6
Mε
ποια αναλογία όγκων πρέπει να αναμειχθούν διάλυμα HCOOH 1M και διάλυμα NaOH 1Μ , προκειμένου να
σχηματισθεί ρυθμιστικό διάλυμα με pH=5; Δίνεται η σταθερά ιοντισμού του HCOOH Ka=10-4.
Άσκηση7
Πόσα mol υδροχλωρικού οξέος (HCl) πρέπει να
προστεθούν σε 500mL διαλύματος αμμωνίας (NΗ3)
0,1Μ για να προκύψει διάλυμα με pH=5;
Δίνονται: Η σταθερά ιοντισμού της βάσης είναι Kb=10-5 και
το γινόμενο ιόντων του νερού Kw=10-14
Άσκηση
8
Διαθέτουμε δύο υδατικά διαλύματα Α και Β
σε θερμοκρασία 25 οC. Το
διάλυμα Α έχει όγκο 500 mL και περιεκτικότητα 0,1Μ
σε NaOH. To διάλυμα Β έχει όγκο
1000 mL , περιέχει ασθενές οξύ ΗΑ και εμφανίζει pH=3. Tα διαλύματα Α και Β
αναμιγνύονται οπότε προκύπτει νέο διάλυμα Γ.
Α) Να υπολογισθεί το pH του διαλύματος Α και η
μοριακή κατ΄ όγκο συγκέντρωση (Molarity) του διαλύματος Β.
Β) Να υπολογισθεί το pH του διαλύματος Γ. Η σταθερά ιοντισμού του
οξέος είναι Ka=10-5 και
το γινόμενο ιόντων του νερού Kw=10-14.









Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου